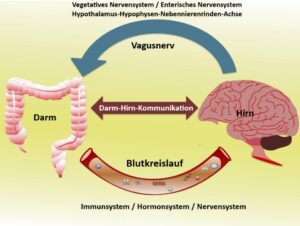
 Die Darm-Hirn-Achse (engl. gut-brain axis) beschreibt die bidirektionale Kommunikation zwischen Darm und zentralem Nervensystem. Daran beteiligt sind Nervenbahnen (vor allem der Vagusnerv und das enterische Nervensystem), Immunsignale, Hormone und eine ganze Bibliothek mikrobieller Stoffwechselprodukte. In den letzten zehn Jahren hat sich dieses Feld vom Nischenthema zum ernstzunehmenden Forschungsgebiet entwickelt – mit Relevanz für Verdauung, Stimmung, Stressreaktionen und möglicherweise neurodegenerative Erkrankungen.
Die Darm-Hirn-Achse (engl. gut-brain axis) beschreibt die bidirektionale Kommunikation zwischen Darm und zentralem Nervensystem. Daran beteiligt sind Nervenbahnen (vor allem der Vagusnerv und das enterische Nervensystem), Immunsignale, Hormone und eine ganze Bibliothek mikrobieller Stoffwechselprodukte. In den letzten zehn Jahren hat sich dieses Feld vom Nischenthema zum ernstzunehmenden Forschungsgebiet entwickelt – mit Relevanz für Verdauung, Stimmung, Stressreaktionen und möglicherweise neurodegenerative Erkrankungen.
Was meint „Darm-Hirn-Achse“ genau?
Klassisch verstand man darunter die Wechselwirkung zwischen Gehirn und enterischem Nervensystem (ENS) – dem „Bauchhirn“. Heute spricht man häufiger von der Mikrobiota-Darm-Hirn-Achse, weil die Billionen Darmmikroben als aktiver Kommunikationspartner erkannt wurden. Sie beeinflussen neuronale, endokrine und immunologische Signalwege; die Interaktion verläuft in beide Richtungen und ist von Rückkopplungen geprägt.
Die wichtigsten „Leitungen“ der Achse – kurz erklärt
1) Neurale Bahnen: Vagusnerv & ENS
Der Vagusnerv fungiert als Hochgeschwindigkeitsleitung vom Darm zum Hirnstamm (afferent) und zurück (efferent). Tier- und Humanstudien legen nahe, dass Veränderungen in der vagalen Signalübertragung Stimmung, Stressantwort und Motilität beeinflussen – bis hin zur therapeutischen Modulation durch Vagusnerv-Stimulation. Das enterische Nervensystem steuert autonom die Verdauung und steht über Vagus- und Sympathikusbahnen in engem Kontakt zum ZNS.
2) Metabolite aus dem Mikrobiom
Bakterielle kurzkettige Fettsäuren (SCFA) wie Acetat, Propionat und Butyrat entstehen aus Ballaststoffen. Sie wirken lokal auf Darmbarriere, Immunzellen und Enterozyten – und systemisch auf Blut-Hirn-Schranke und Mikroglia (die Immunzellen des Gehirns). In keimfreien Mausmodellen normalisiert die Zugabe von SCFA die Mikroglia-Reifung.
3) Tryptophan-/Serotonin-Achse
Rund 90 % des körpereigenen Serotonins werden im Darm von enterochromaffinen Zellen produziert. Bestimmte sporenbildende Darmbakterien steigern diese Synthese – ein Mechanismus, der das neuronale und immunologische Geschehen modulieren kann.
4) Immun- und Stressachse
Mikrobielle Muster und Metabolite „primen“ das Immunsystem und beeinflussen die Hypothalamus-Hypophysen-Nebennieren-Achse (HPA). Stress verändert wiederum die Darmbarriere und die Mikrobiota – ein Kreislauf, der Entzündungen fördern kann. Aktuelle Reviews betonen die Rolle des Entzündungsgeschehens in dieser Wechselwirkung.
Was ist gesichert – und was (noch) nicht?
Solide belegt ist die Existenz mehrerer, sich überlagernder Kommunikationskanäle zwischen Mikrobiota, Darm und Gehirn. Präklinisch zeigen keimfreie Tiere, antibiotische Interventionen oder Fäkaltransfers reproduzierbare Effekte auf Stressantwort, Mikroglia, Neurotransmitter und Verhalten.
Beim Menschen ist die Lage differenzierter: Für Reizdarmsyndrom (IBS) – eine klassische Störung der Darm-Hirn-Achse – belegen große Metaanalysen, dass Probiotika im Mittel globale Symptome verbessern, wenn auch heterogen je Stamm und Studiendesign.
Für depressive Symptome deuten Metaanalysen und RCTs auf kleine bis moderate Effekte probiotischer Ergänzungen als Add-on-Therapie hin; die Evidenz ist jedoch uneinheitlich und von Studiendesigns, Stämmen und Begleittherapien abhängig. Einzelne neuere RCTs berichten klinisch relevante Verbesserungen. Fazit: vielversprechend, aber (noch) nicht standard-leitlinienreif.
Fäkale Mikrobiota-Transplantation (FMT) ist bei wiederkehrender C. difficile-Infektion inzwischen zugelassen; für psychische Störungen existieren bislang nur Machbarkeits-/Pilotdaten und laufende Studien. Eine Anwendung außerhalb von Studien wird derzeit nicht empfohlen.
Mechanismen – ein wenig tiefer gegraben
- SCFA ↔ Mikroglia/Neuroinflammation: Keimfreiheit oder reduzierte mikrobielle Vielfalt führt zu fehlreifer Mikroglia; SCFA-Gaben (und Signalübertragung über FFAR2/3) normalisieren Funktionen und dämpfen inflammatorische Reaktionen. Gleichzeitig gibt es Hinweise, dass SCFA kontextabhängig auch pro-algetische Mikroglia-Programme triggern können – die Dosis und das Zusammenspiel mit Immunreizen scheinen entscheidend.
- Serotonin & Co.: Sporenbildner fördern die 5-HT-Synthese im Darm; serotonerge Signale beeinflussen Motilität, Thrombozyten-Funktion und möglicherweise Stimmung (indirekt über Immun- und Vagusbahnen). Neue Übersichten ordnen dieses Puzzleteil in ein breiteres Netzwerk aus Neurotransmittern (GABA, Dopamin u. a.) ein.
- Vagus als Sensorik-Leitung: Moderne Tracing- und Einzelzell-Analysen zeigen spezialisierte vagale Afferenten, die Nährstoffe und mikrobielle Signale detektieren; experimentelle Vagus-Modulation beeinflusst Angst- und Depressionsverhalten in Modellen. Klinisch wird Vagusnerv-Stimulation bereits bei therapieresistenter Depression eingesetzt – der mikrobiomvermittelte Anteil daran wird derzeit intensiv diskutiert.
Klinische Facetten: von Darmbeschwerden bis Stimmung
- Reizdarm (IBS): IBS vereint viszerale Hypersensitivität, Motilitätsstörungen, Stressvulnerabilität und eine veränderte Mikrobiota. Probiotika zeigen im Mittel eine Symptomlinderung; Aussagekraft zu welchem Stamm, welcher Dosis, welcher Dauer bleibt eingeschränkt. Lebensstilmaßnahmen (Ballaststoffe, Stress-Management) sind Basis.
- Depressive Symptome/Angst: Metaanalysen (Erwachsene) finden kleine bis moderate Verbesserungen unter Probiotika, teils stärker bei adjunktiver Gabe zur Standardtherapie; in Kinder-/Jugendstudien ist die Datenlage noch dünn. Ein Placeboeffekt und Publikationsbias können eine Rolle spielen – dennoch sind „Psychobiotika“ ein aktives Forschungsfeld.
- Neurologie: Hypothesen zu Parkinson (α-Synuclein-Ausbreitung über den Vagus), MS, Schmerzsyndromen und Kognition werden beforscht; gesicherte, breite Therapieempfehlungen fehlen.
Was bedeutet das praktisch? Evidenzbasierte Alltagstipps
1) Ballaststoffe priorisieren
Zielen Sie auf ≥ 25–30 g/Tag lösliche und unlösliche Ballaststoffe (Vollkorn, Hülsenfrüchte, Gemüse, Nüsse). Je mehr fermentierbare Fasern, desto mehr SCFA – die Schlüsselmetabolite für Barriere, Immunbalance und (indirekt) Gehirn.
2) Fermentiertes regelmäßig einbauen
Naturjoghurt, Kefir, milchsauer eingelegtes Gemüse (z. B. Kimchi, Sauerkraut) liefern lebende Kulturen und organische Säuren. Klinisch gesicherte Effekte sind stamm- und dosisabhängig; als Baustein eines gesunden Ernährungsmusters sind sie sinnvoll und gut verträglich.
3) Stress & Schlaf ernst nehmen
Chronischer Stress verstärkt HPA-Aktivierung und „leaky gut“; Schlafmangel korreliert mit Dysbiose. Entspannungsverfahren, Bewegung und Schlafhygiene stützen die Achse – und sind integraler Bestandteil jeder IBS- oder Depressions-Therapie.
4) Probiotika überlegt einsetzen
Bei IBS kann ein zeitlich begrenzter Probiotika-Versuch (z. B. 4–8 Wochen) erwogen werden; idealerweise mit Stämmen, für die es RCT-Signale gibt und als Add-on zu Ernährung/Verhalten. Bei depressiven Symptomen ausschließlich als Ergänzung zur Regeltherapie und nach ärztlicher Rücksprache.
5) FMT nur im Studien-/Spezialsetting
Außer bei rezidivierender C. difficile-Infektion (zugelassen) sollte FMT derzeit nicht außerhalb klinischer Studien eingesetzt werden.
Häufige Fragen – kurz beantwortet
„Kann ich meine Stimmung mit Nahrung verbessern?“
Eine ballaststoff- und pflanzenbetonte Kost (Mediterranes Muster) mit Fermenten ist „Achsen-freundlich“ und kann als Add-on zur Behandlung depressiver Symptome sinnvoll sein. Ersetzen kann sie eine leitliniengerechte Therapie nicht.
„Gibt es die Darmflora für psychische Gesundheit?“
Nein. Das Mikrobiom ist individuell wie ein Fingerabdruck. Wichtiger als einzelne „Wunderkeime“ scheint die Diversität und funktionelle Kapazität – gefüttert durch vielfältige, faserreiche Kost.
„Wie schnell ändert sich die Darmflora?“
Mikrobielle Profile reagieren innerhalb von Tagen auf Ernährung; stabile, klinisch relevante Effekte benötigen meist Wochen bis Monate – und fallen individuell aus.
Fazit
Die Darm-Hirn-Achse ist keine esoterische Idee, sondern ein multikanaliges biologisches Kommunikationsnetz, in dem das Mikrobiom eine zentrale Rolle spielt. Besonders gut belegt sind Zusammenhänge bei IBS; bei psychischen Symptomen gibt es erste klinische Signale, aber noch keine universellen Rezepte. Was heute schon sinnvoll ist: Ballaststoffe hoch, Fermente regelmäßig, Stress managen, Bewegung & Schlaf pflegen – und probiotische oder gar FMT-Interventionen nur wohlüberlegt und ärztlich begleitet einsetzen. So lässt sich die Achse pragmatisch stärken, während die Wissenschaft die Feinmechanik weiter entschlüsselt.
Text- und Bild-Quellen auf Nachfrage beim Autor